
Atomer
Atom betyder odelbar. Redan 400 f. Kr, framlade filosoferna teorier om hur atomen kunde plockas isär, som om den bestod av olika byggstenar, vilka kanske kunde sättas samman till en atom igen - kanske rent av en annan sorts atom. Alkemisterna försökte förgäves omvandla atomerna (för att förhoppningsvis skapa guld), men det är inte förrän man byggt stora partikelacceleratorer som vi kan skapa guld av bly: detta sker genom att beskjuta blyatomer med protoner. Men än så länge är detta guld dyrare att framställa än traditionella metoder.
En atom består av en eller flera protoner, som är samlade i en kärna. En proton har en positiv laddning av storlek 1. Det är praktiskt vid beräkningar. Tyvärr är enheten 1 illa vald, då en proton består av tre kvarkar.
En atom har i regel lika många elektroner som protoner. Elektronerna cirkulerar runt atomkärnan i olika banor. Elektronen är negativt laddad med storleken -1. En atom med sitt normala antal elektroner är utåt sett neutral. Berövas atomen en elektron, blir den elektriskt laddad, statiskt laddad eller även kallad joniserad: atomen blir positivt laddad med storleken 1.
Den enklaste atomen är väte, som endast innehåller en elektron och en proton.
Elektronerna är samlade i ”skal” runt atomkärnan. Men i denna lilla värld finns andra lagar än vad vi är vana vid: man kan bara tala om hur pass sannolikt det är var en elektron befinner sig. Rörelsemönstren för elektronbanorna är egentligen mycket mer komplicerade än ett ”skal”. Ju fler gånger man mäter, ju klarare framträder ett mönster; men det går aldrig att beräkna exakt var man förväntas påträffa en elektron. Bilden visar var man kan förväntas träffa på den enda elektronen som finns i en väteatom. Ju mörkare, ju sannolikare.
Ref: På resa i universum, Universums Skapelse, bokförlaget Lademann.

Atomen kan innehålla fler än en proton: det är denna uppställning man samlar i tabeller och benämner olika grundämnen. Det finns förmodligen ingen gräns för hur många protoner det kan var i en atomkärna, men då dessa atomer inte existerar så länge, finns de inte i naturen, utan kan bara skapas i laboratorier. Atomkärnan kan innehålla drygt hundra protoner, ha ungefär en och en halv gång så många neutroner och lika många elektroner som protoner. Elektronerna snurrar i bestämda banor runt kärnan, i så kallade skal. Neutronerna har neutral laddning.
Storleken på en atom är ungefär 10-8 cm.
Ett intressant exempel att räkna ut atomens storlek, är att börja med en stång som är en meter lång. Denna delar man mitt av. Ena halvan delar man ännu en gång. Man gör 37 sådana upprepade delningar, sedan går stången inte att dela mera!
Storleken på kärnan är betydligt mindre än atomen, omkring 10-14 cm. Om en atom var så stor som jorden, skulle vi inte upptäcka kärnan: den skulle i den skalan vara lika stor som en fotboll. Det skulle vara ganska svårt att hitta en fotboll i jordens inre.
Stången i exemplet kan vi dela ytterligare 9 gånger: då har vi även delat atomen och kommit in till kärnan.
Ref: Här är vi hemma. Bra Böcker 1982.
Eftersom man inte kan fösa ihop flera positivt laddade partiklar med varandra, som till exempel protoner, måste man ha ytterligare en kraft, som håller samman kärnan, för att förhindra den från att repellera. Det är inte neutronerna som fungerar som lim för protonerna - neutronerna är ju neutralt laddade. Nej, man kallar det för “den starka kraften”: denna behövs för att hålla samman protonerna. Denna fungerar endast på mycket små avstånd och håller samman kärnan - eller försöker hålla samman kärnan.
Då antalet protoner i kärnan överstiger 82, som är protontalet för bly, kan atomen sporadiskt sönderdela sig själv. Detta kallar vi radioaktivt sönderfall. Vid sönderfallet kan ett litet antal neutroner och protoner kastas ut ur kärnan, varvid en eller flera nya atomer bildas i stället. Det verkar, som om den starka kraften inte orkar hålla ihop alltför många protoner. Vid sönderfallet bildas värme: det är det man utnyttjar i atombomber och kärnkraftverk. Hur fort en radioaktiv atom faller sönder är olika, beroende på hur många neutroner och protoner den innehåller. Man kallar tiden för halveringstid: då det gått en viss tid, har hälften av atomerna med en viss uppsättning av neutroner och protoner i ett visst material fallit sönder. Då samma tid förflutit en gång till, har hälften av resterande atomer fallit sönder och så vidare. Man talar om halveringstider på 10 000 år eller bråkdelar av sekunder för olika slags atomer. Halveringstiden är universell: man kan mäta hur gamla avlägsna objekt ute i rymden är. Halveringstiden är också oberoende av upparbetning: man kan till exempel omarbeta uranstavar, så de innehåller tillräckligt mycket av en radioaktiv typ av uran (isotop), som är lämplig för kärnkraftverk. Halveringstiden är alltid densamma, utom när man sätter samman uranstavar tätt: det radioaktiva sönderfallet skenar då iväg (kedjereaktion), varvid det kan bli en härdsmälta eller atombomb.
Sönderfallskedjan för uran kan vara: uran - protaktinium - aktinium - radium - francium - radon - astatin - plutonium - vismut - (tallium) - bly, men det finns andra sönderfallskedjor. Radioaktiviteten kallas fission.
I solens inre sker det motsatta: små atomkärnor pressas samman till att större genom tryck och hetta. Detta kallas fusion och avger också värme. Väte byggs via olika kedjor upp till järn, men tyngre atomer kan inte byggas upp i solens inre. För att tyngre atomer än järn ska kunna skapas, krävs större tryck och värme än vad som finns i solen. Det sker i en supernova, då solen eller en stjärna gjort slut på sitt bränsle, blir instabil och exploderar.
Atomernas åtta tillstånd
Vi har fått lära att det finns tre tillstånd för atomer: fast, flytande och gas. Tillståndet mellan de två första kallas för stelning eller smältning, normalt benämnt smältpunkt; mellan de två andra tillstånden kallas det för kondensering eller avdunstning, normalt benämnt kokpunkt. Temperaturerna för smältpunkt och kokpunkt är olika för olika atomer: detta i sin tur beroende på trycket som ämnet utsätts för. Kvicksilver är en metall som är flytande i rumstemperatur. Kväve är flytande då gasen kylts ner eller pressats samman tillräckligt.
Smältpunkt och kokpunkt är som nämnt beroende av tryck: bergsklättrare har problem att få upp värmen, eftersom en värmande dryck kanske tyvärr kokar redan vid 90°. Vattenånga kan vid lågt tryck och låg temperatur gå direkt över till fruset tillstånd: det är så snökristaller bildas. Kolsyreis smälter inte: i vanlig luft (normalt lufttryck) avdunstar isen direkt: den kallas därför också för torr-is.
Men normalt finns det som nämnt tre tillstånd för varje atom: fast, flytande och gas. Ju varmare, ju hastigare rörelser hos atomerna: ämnet går från stelnat tillstånd över vätska till en gas, efterhand som bindningarna mellan atomerna slits upp. Ju kallare, desto långsammare rörelser: atomerna går från gas över till vätska för att stelna, ofta i form av regelbundna kristaller. Allt kan stelna utom Helium: dels för att det är en ädelgas, dels för att ämnet har så låg vikt.
Forskarna har emellertid upptäckt att det finns ytterligare fyra tillstånd för atomerna.
Vid mycket kallt tillstånd, nära den absoluta nollpunkten, -273,15°C eller 1°K, uppför sig alla atomer som en enda enhet. Tillståndet kallas BEC, Bose-Einstein-kondensat. Nära den absoluta nollpunkten är atomerna så långsamma, att de slår sig samman till en enda vågmassa, en superatom. Temperaturen är tio miljondelar över den absoluta nollpunkten: en sådan låg temperatur finns inte ute i universum, utan bara i laboratorier. Man kommer aldrig ner till den absoluta nollpunkten, eftersom atomerna aldrig kommer att vara helt orörliga: en viss växelverkan finns alltid mellan dem.
Ref; Illustrerad Vetenskap 11/95.

Beroende på vad det är för ämne i Bose-Einstein-kondensatet, kan det vara fast, flytande eller gas. Gemensamt är att ämnet är så kallt, att alla atomer svänger i en och samma fas. Det finns inte energi nog för att en enstaka atom ska svänga annorlunda eller börja ge sig av.
Kyler man ner helium så mycket, blir det supraflytande, det vill säga att ämnet flyter utan motstånd.
Ref: Ny Teknik 6/04.
Något över den absoluta nollpunkten har alla slags atomer bildat ett fast ämne. Atomerna har bildat kärnor av neutroner och protoner (vätekärnan innehåller bara en proton, ingen neutron). Atomerna är placerade i ett välordnat gittersystem och bildar stabila kristaller.
Vid ännu högre temperatur lossas gitterstrukturen delvis mellan atomerna. Ämnet är flytande. Temperaturen ligger mellan ämnets smältpunkt och kokpunkt.
Vad man kommit fram till, kan ett ämne vara flytande på två olika sätt, beroende på trycket. Man har upptäckt att fosfor kan vara flytande på två olika sätt. Liknande frågor har man ställt sig om vatten: är det en blandning av flera distinkta vätskor i olika tillstånd, eller ändras ordningen mellan molekylerna i takt med att man ändrar på vätskans tryck?
Ref: Forskning & Framsteg 1/05.
Vid ännu högre temperatur är gitterstrukturen helt borta. Atomerna rör sig fritt i förhållande till varandra. Kärnan är fortfarande hel och elektronerna kretsar runt kärnan. Tillståndet kallas gas.
Vid ännu högre temperatur är atomerna splittrade: partiklarna är helt fria. Tillståndet kallas plasma och återfinns i stjärnor och laboratorier.
Ref: Illustrerad Vetenskap 3/97.

Det periodiska systemet
Inledningsvis nämndes att en atomkärna kan ha en till flera protoner. Väte har normalt ingen neutron. Helium har normalt två protoner och två neutroner. Men ju större antal protoner en atom har, desto närmare förhållandet 1,5 gånger så många neutroner som protoner gäller. Antalet neutroner kan emellertid variera något för en viss atomtyp: det kallas för isotoper. Om en atom kan ha olika isotoper, är i regel bara en isotop stabil: de ostabila faller förr eller senare sönder för att bilda en atom med ett lämpligt förhållande mellan protonerna och neutronerna.
Om en elektron rycks bort från en atom, kanske med hjälp av statisk elektricitet, eller med elektromagnetisk påverkan, blir atomen positivt laddad: den vill ta upp en fri elektron för att åter bli neutralt laddad. Det är på så sätt ström går i metaller: en atom i en metall avger lätt en elektron: den lösa elektronen hoppar från atom till atom. Om ett ämne går att ladda upp statiskt är en del elektroner bortryckta, samtidigt som ämnet har en sådan elektriskt isolerande förmåga, att elektronerna har svårt att hoppa tillbaka igen.
Elektronerna samlas i olika skal runt atomen: skalen numreras K, L och så vidare. Elektronerna fylls på i ett skal först, innan ett påföljande skal kan fyllas på. Hur många elektroner som ingår i ett skal, innan det är fyllt, är förutbestämt och varierar inte mellan olika sorters atomer. Antalet elektroner i det första skalet är 2, i nästa skal 8, nästa 8, sedan 18 och så vidare. Det fylls på inifrån och ut.
Om det yttersta elektronskalet är fyllt, är atomen kemisk neutral och vill inte gärna ingå i kemiska reaktioner. Guld, silver och titan är exempel på metaller som är kemiskt neutrala och har helfyllda skal: dessa metaller oxiderar inte alls eller har mycket svårt att oxidera. Med salpetersyra (skedvatten) kan man lösa upp silver från guld, medan man måste ha en blandning av saltsyra och salpetersyra (kungsvatten) för att lösa upp guld. Det är väldigt svårt att utvinna de nämnda metallerna ur malm.
Om en atom däremot fattas en elektron för att ha ett fyllt ytterskal, vill den gärna försöka fylla ut skalet med en extra elektron: detta kan ske med en kemisk bindning med en atom som har en ensam elektron i sitt yttersta skal. Atomerna kan inte skaffa eller göra av med en elektron, eftersom den då blir statisk laddad; däremot kan två lämpliga atomer slå sig samman för att fylla ut det yttersta elektronskalet. Detta kan ske med lämpligt slag av atomtyper.
En atom kan också fattas två elektroner för att få ett helfyllt skal, kan antingen förena sig med en atom som endast har två elektroner i yttersta skalet, eller förena sig med två atomer som endast har en elektron i yttersta skalet.
Vi kallar föreningen mellan olika atomtyper för en kemisk förening eller jonbindning. Koksalt, natrium-klorid är ett exempel på en sådan kemisk förening.

Två likadana atomer kan förena sig till en så kallad kovalent bindning för att fylla upp ett elektronskal. Ett exempel på en kovalent bindning är två syrgasmolekyler.
I metallerna bildar atomerna kristallstruktur. Elektronerna vandrar fritt mellan atomerna.

Om energi tillförs en atom, kan en elektron hoppa upp i ett högre skal, ett exciterat tillstånd. Då elektronen hoppar ner till en lägre bana, avges energikvanta i form av en elektromagnetisk signal, som kan vara en foton, ett ljusknippe, men även röntgenstrålning med mera. Varje atom avger sitt typiska våglängd, ljus (färg) röntgenstrålning e t c för varje elektronsprång och elektronskal.
Det vi kallar elektronskal är egentligen mycket komplicerade elektronbanor, som vi ska återkomma till. Åtta elektroner kan ju inte gå i samma skal utan att kollidera, om de inte går i mycket speciella banor.
Det periodiska systemet
Det periodiska systemet började med att man startade med att förkorta grundämnena efter sina latinska namn.
Dessutom hade alkemisterna speciella symboler för de grundämnen de hade upptäckt.
.svg/770px-Periodic_table_(polyatomic).svg.png)
Vi kan se att översta raden innehåller två grundämnen. Dessa två motsvarar de två elektroner som kan finnas i första skalet. Nästa rad innehåller åtta grundämnen. Dessa motsvarar de åtta elektroner som kan finnas i nästa skal o s v. Nästa rad har 8, nästa 18 o s v.
Efterhand som man upptäckte eller skapade fler grundämnen, kom man fram till att 18 kolumner inte räckte till. Man fick skjuta in 14 grundämnen, 57 - 71 (Lantanioder) samt 89 - 103 (Aktinoider).
Syre, kväve, kisel och kol är de ämnen som lättast bildar kemiska föreningar.
Järn rostar som bekant lätt, men en legering mellan järn, krom och nickel används för rostfritt stål.
De metaller som inte oxiderar är guld, silver och titan. Titan användes för sportbilar och inom kirurgin, eftersom den är en lätt, relativt stark metall som inte oxiderar.
Olika grundämnen har olika elektrisk spänning. Har man två elektroder av olika material och tillsätter förorenat vatten eller utspädd syra, uppstår ett galvaniskt element eller ett batteri. På detta sätt kan man till exempel förgylla föremål: atomerna vandrar i ett elektrolytbad, med påslagen spänning mellan två elektroder. Länk
En försinkad järnplåt läker skador, eftersom sinken bryts ner och täcker järnet (förutsatt att skadan kommer i kontakt med förorenat vatten). På båtar har man därför en offeranod av sink: eftersom båten är i förorenat vatten (eller saltvatten) bryts sinken ner och täcker skador. Eftersom regn är relativt rent, räcker det inte med en offeranod på bilar: här får man i stället försinka hela järnpartier.
Har man en maskin som kommer i beröring med förorenat vatten (det räcker med inbyggda kylkanaler) och denna maskin består av olika metall-legeringar, bryts vissa metaller ner. Ofta är maskinerna sammansatta av kopparrör, rostfritt stål, försinkade järndetaljer och aluminium. Små aluminiumdelar fräts upp och försvinner. Sinken fräts upp, varefter underliggande järn rostar. Man har alltså byggt ett galvaniskt element.
Ofta använder man en metalloxid för att framställa färg. Kalium och kadmium ger röda och gula färgstoff; titan, zink och bly ger vitt; krom ger blått och grönt; järn ger rött och gult; kobolt ger blått. Guldoxid användes förr för att skapa röda färgprickar på färg-TV, men jag vet inte om man har gått ifrån guldoxiden i dag. Jag minns att en färg-TV kostade 4000 kronor 1966: en tusenlapp bara för de röda prickarna av guld.
Bland metallerna har kvicksilver den lägsta smältpunkten. Överdelen av Klippans fyr står på ett bad av kvicksilver: järnkonstruktionen med glasprismor som ska rotera flyter på kvicksilvret. Volfram har den högsta smältpunkten bland metallerna: man gör bland annat glödlampstrådar av den.
Väteatomens vikt är 1,66*10-24g. Elektronen väger 1/1846-del av väteatomen.
Tidigare nämndes kovalent bindning mellan två likadana atomkärnor. Ett avstånd mellan atomkärnorna för syre i en sådan bindning är 0,7 atomdiametrar. För metallisk eller kristallisk struktur är avståndet mellan två atomer, för till exempel järn, 1,2 atomdiametrar.
Skapande av nya sorters atomer
Man hade nytta av att göra upp ett schema som det periodiska systemet (ovan). Man fann luckor i schemat, men hittade så småningom grundämnen i naturen, som passade i luckorna. Genom att jämföra med andra ämnen i tabellen kunde man ana sig till hur det eftersökta ämnet skulle bete sig, vilket underlättade sökandet. På jorden hittade man upp till grundämne 98, Californium.
Man började bygga laboratorier, där man med hög hastighet sköt protoner mot metallplattor, gjorda till exempel av bly eller guld. (Protoner användes ofta, då dessa är lätta att utvinna ur väte, är tunga och laddade: med rörformade kraftiga magneter kan man få dem att accelerera iväg med hög hastighet.) Vid beskjutningen uppstod nya grundämnen, som inte tidigare fanns i naturen. Dessa hade ännu kortare halveringstider än de man hade hittat på jorden, vilket var naturligt: atomer med korta halveringstider hade försvunnit från jorden och kunde inte återskapas på jorden på naturlig väg. Tunga högradioaktiva grundämnen kan av naturen själv bara skapas då stjärnor kollapsar, då tillräckligt tryck och värme uppstår: Sådana högradioaktiva grundämnen kan ha kommit genom rymden och fallit ned på den nybildade jorden, men med tiden försvunnit, genom att de ombildats till andra ämnen på grund av radioaktivitet.
Man började så småningom stå inför svårigheten att hitta på namn till de nya grundämnena som man skapade. Se till exempel 117 och 118 i tabellen med det periodiska systemet.
Ett annat sätt att återge det periodiska systemet är ett schema i spiralform, skapat av Theodor Benfey. Det visar på ett elegant sätt de inskjutna grupperna lantaniderna och aktiniderna, och förutsäger en ny inskjuten grupp bland de hittills oupptäckta supertunga grundämnen. Länk
Kristallisk struktur i metaller
Den kristalliska strukturen är olika för olika metaller, men också olika beroende på hur man framställer materialet: gjutet och smitt järn bildar olika typer av kristaller, beroende på hur fort atomerna hinner bilda gitter, då ämnet håller på att stelna.
Vid smidning, valsning, bockning, klippning och annan plastisk bearbetning av materialet skjuvas ett atomlager en liten bit: ungefär en atom i taget, men också halva eller flera atomlängder förekommer.
Jämför med de olika sätt som finns, hur man kan stapla apelsiner! Har du tio apelsiner, kan du stapla dem till en tetraeder: du får då sex apelsiner i första lagret, tre i andra och en på toppen.
Det finns flera olika sorters kristalliska strukturer, gitter. Du kan också stapla 14 apelsiner, så att du lägger nio i första lagret, fyra i andra och en på toppen: detta bildar en pyramid.
Atomerna skjuvas olika lätt i olika riktningar vid plastisk bearbetning: pyramidstaplingen låser atomlagren mera än tetraederstaplingen. Vid uppvärmning och avkylning av material inom bestämda tider och temperaturintervaller får man kristallstrukturen att flytta om och ändra sig efter önskemål: detta kallas härdning och anlöpning. Härdning gör ytan på materialet hård, men sprött: anlöpning mjukar upp materialet en smula igen.
Förutom kristallisk struktur, som då man staplar apelsiner i tetraederform eller pyramidform, finns kristallisk hexagonalisk struktur: du placerar då 7 apelsiner i första lagret och placerar därpå 7 apelsiner rakt ovanpå dessa. Atomlagren glider mycket lätt i en riktning, men har mycket svårt att glida i andra riktningar. Zink och magnesium har en sådan kristallstruktur,

För att förhindra atomlagren från att glida, blandar man in andra sorters atomer: en mindre eller större atom i grundmaterialet stör kristallmönstret och kan göra glidningen svårare. Detta kallas legering.

Då ett material stelnar, lägger sig inte alla atomer i prydliga kristalliniska strukturer - alla atomer hinner inte göra det. Ett smält ämne som svalnar, stelnar först på ytan, där värmen avges snabbast: där börjar öar av kristaller att byggas upp. Då ytan stelnat till ett fast ämne, gäller det för atomerna längre in i materialet att bilda kristaller: här bildas nya öar, alla med kristallerna i slumpmässig rumsorientering. Vid kristallbildning kräver atomerna mindre utrymme än vid smält tillstånd: ytan på materialet kommer därför att sjunka in. Vissa atomer hinner inte lägga sig i ett kristalliskt mönster innan ämnet blir fast: man kan finna vakanser i en kristallstruktur, men också en extra inpressad atom. Smidning, valsning, dragning, härdning och anlöpning kommer att ombilda dessa kristallbildningar och rätta till vakanser eller inpressade atomer. Åldring gör att spänningar i materialet minskas, samtidigt som bindningen mellan ett atompar släpper: det kommer att finnas lösa skikt mellan atomlagren inne i materialet. Oregelbundna kristallbindningar gör att materialet åldras.
Ref: Karlebo Materiallära.


Det är väldigt svårt att fotografera atomerna. Ljus förstör atomen och förändrar den till oigenkännlighet. Processen kan jämföras med att bombardera en mygga med bowlingklot för att studera den.
Det finns emellertid en möjlighet att studera atomerna i en kristall eller i en metall. En oerhört spetsig elektrod förs över ämnet man ska studera. Elektroner överförs från atomerna till nålens spets: detta orsakar en varierande elektrisk spänning, som kan mätas.

I spindeltråd ligger varje molekyl på rätt plats. Därför är spindeltråd (eller spindelsilke) starkare än stål. Det finns alltid någon ojämnhet i stål, som försvagar materialet.
Nanoteknik
Med samma teknik som då man studerar enstaka atomer med en nålspets, kan man knuffa på atomerna och med en liten spänning flytta eller lyfta enstaka atomer.
Här är en film där man knuffar på atomerna. Världens minsta film.
För att studera hur atomerna är placerade, studerar man objektet med ett atomkraftmikroskop. Man kan kombinera alla möjliga slags atomer, och på det viset skapa bryggor och fästpunkter. Forskarna kallar det nano-lego.
Det intressanta är att man kan packa informationen på detta sätt: Hela Nationalencyklopedin kan i dag packas på en CD-skiva, med bilder och allt, men med nanotekniken kan den packas på några kvadratmillimeter.
Det är också intressant att studera när ett ämne inte känns igen längre i mikrovärlden. Guld upphör att glimma, vara elektriskt ledande och att vara elastiskt vid mindre enheter. Övergången mellan makro- och mikrovärden sker gradvis.
Ref: Forskning & Framsteg 7/00.
Elektronernas banor
Diagrammet visar elektronskal och orbitaler för elektroner. Siffrorna 1 - 7 betecknar elektronskal. Bokstäverna s, p, d och f betecknar olika orbitaler för elektronen. Varje streck kan rymma två elektroner. Elektronerna går in i orbitaler på lägsta möjliga energinivå.
Ett exciterat tillstånd för elektronen innebär att den går upp till nästa högre energinivå.
Det sker en koppling mellan atomkärnan och det exciterade tillståndet hos elektronen. Forskarna tror att energin kan hoppa fram och tillbaka mellan elektronerna och kärnan, utjämna energifördelningen och styra det radioaktiva sönderfallet.
Ref: Ny Teknik 38/00Tabellen nedan visar elektronkonfigurationen för grundtillstånden av elementen väte till neon. Varje ruta rymmer två elektroner med motsatt spinn. Antalet elektroner med parallella spinnriktningar är så stort som möjligt i varje orbital. Ref: Nationalencyklopedin, periodiska systemet.
| 1s | 2s | 2p | |||
| H |
|
||||
| He |
|
||||
| Li |
|
|
|||
| Be |
|
|
|||
| B |
|
|
|
||
| C |
|
|
|
|
|
| N |
|
|
|
|
|
| O |
|
|
|
|
|
| F |
|
|
|
|
|
| Ne |
|
|
|
|
|
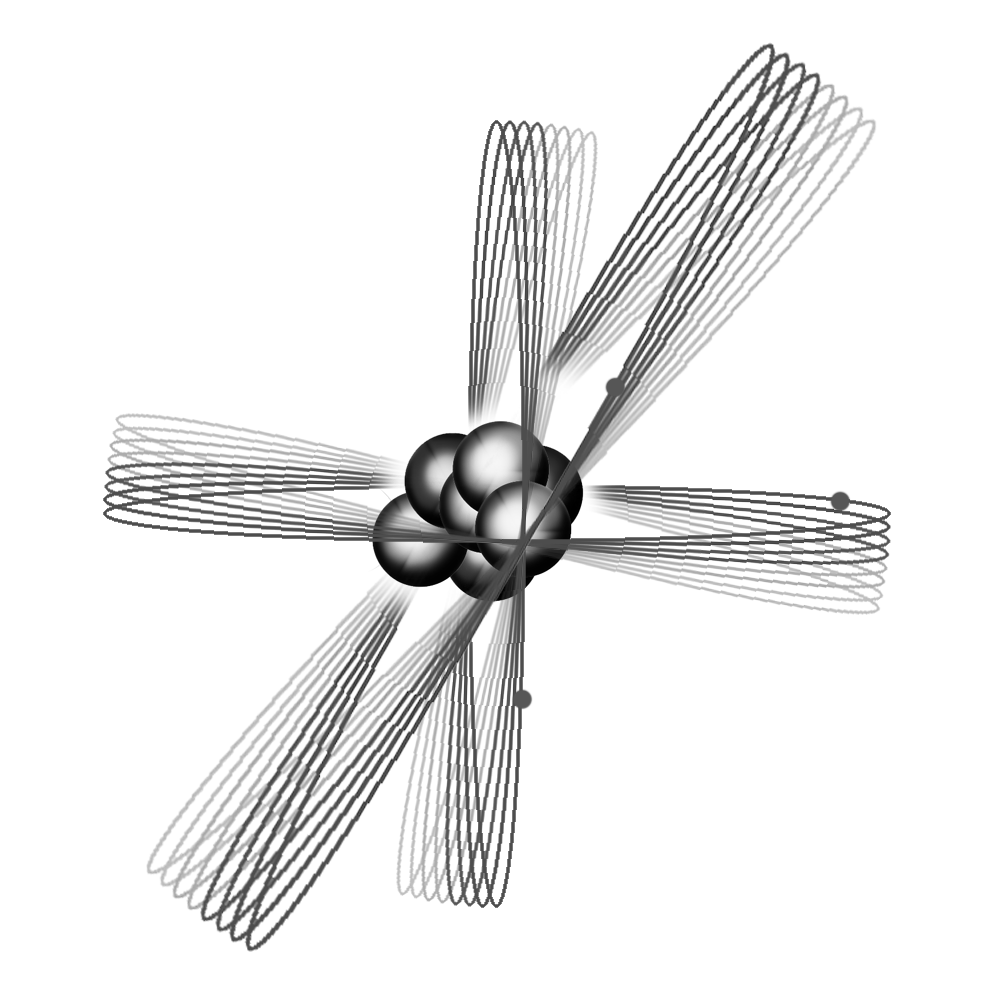
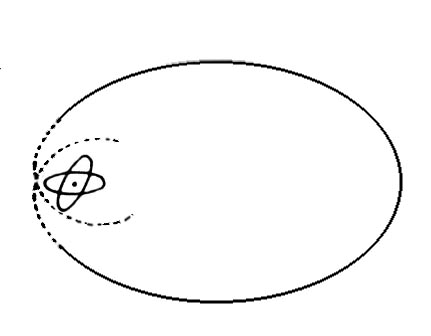
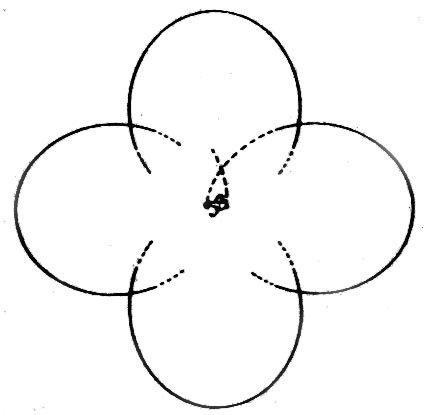
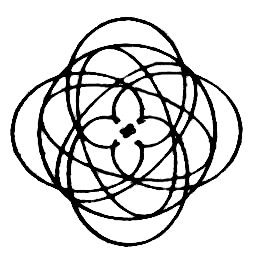
Vi ska också titta på elektronbanor för en del atomer och molekyler. Banorna är i stort sett grundade på matematiska beräkningar och studier av kemiska bindningar.
 |
 |
 |
 |
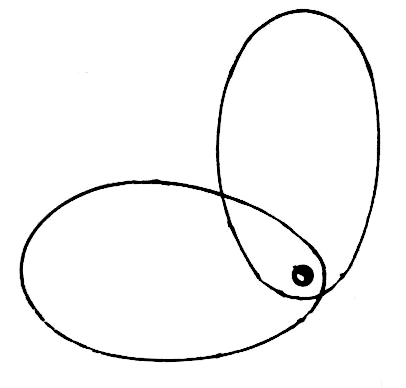 |
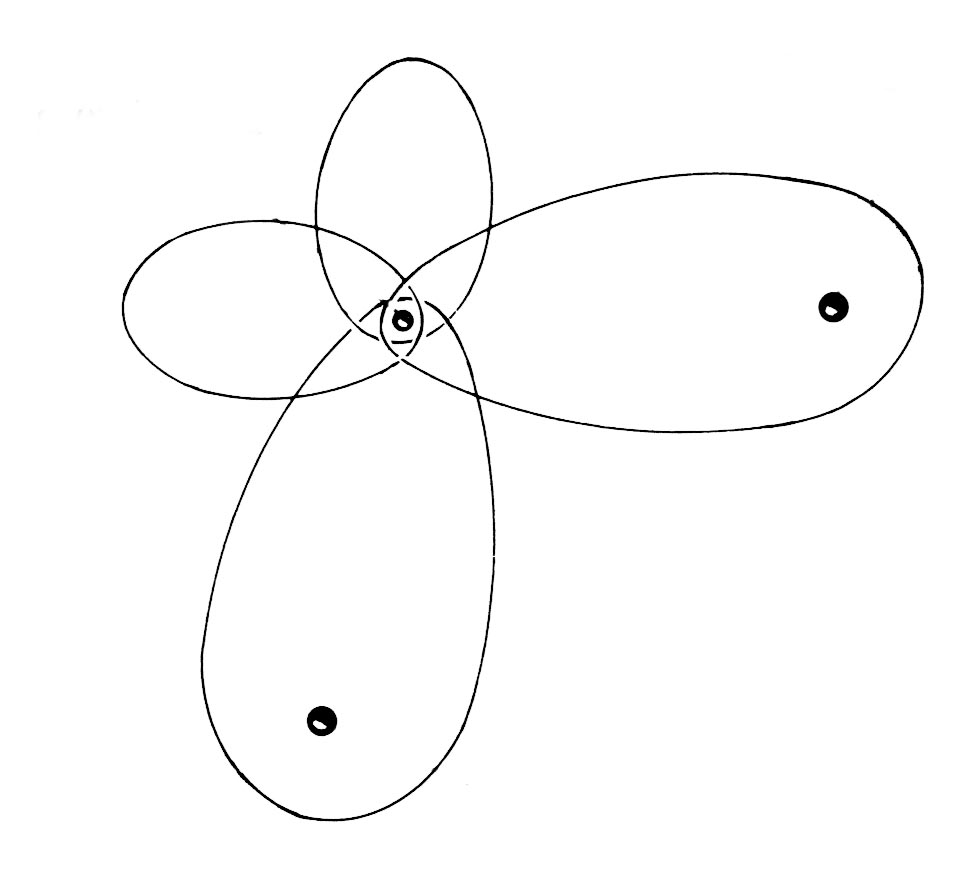
| Väte | Helium | Litium | Kol | Syre |
 |
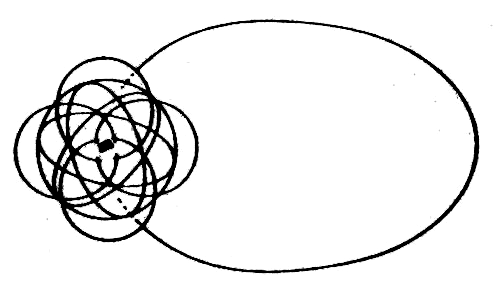 |
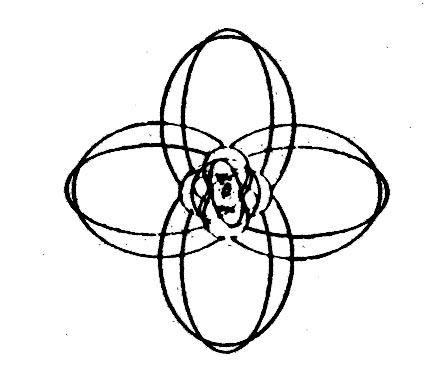 |
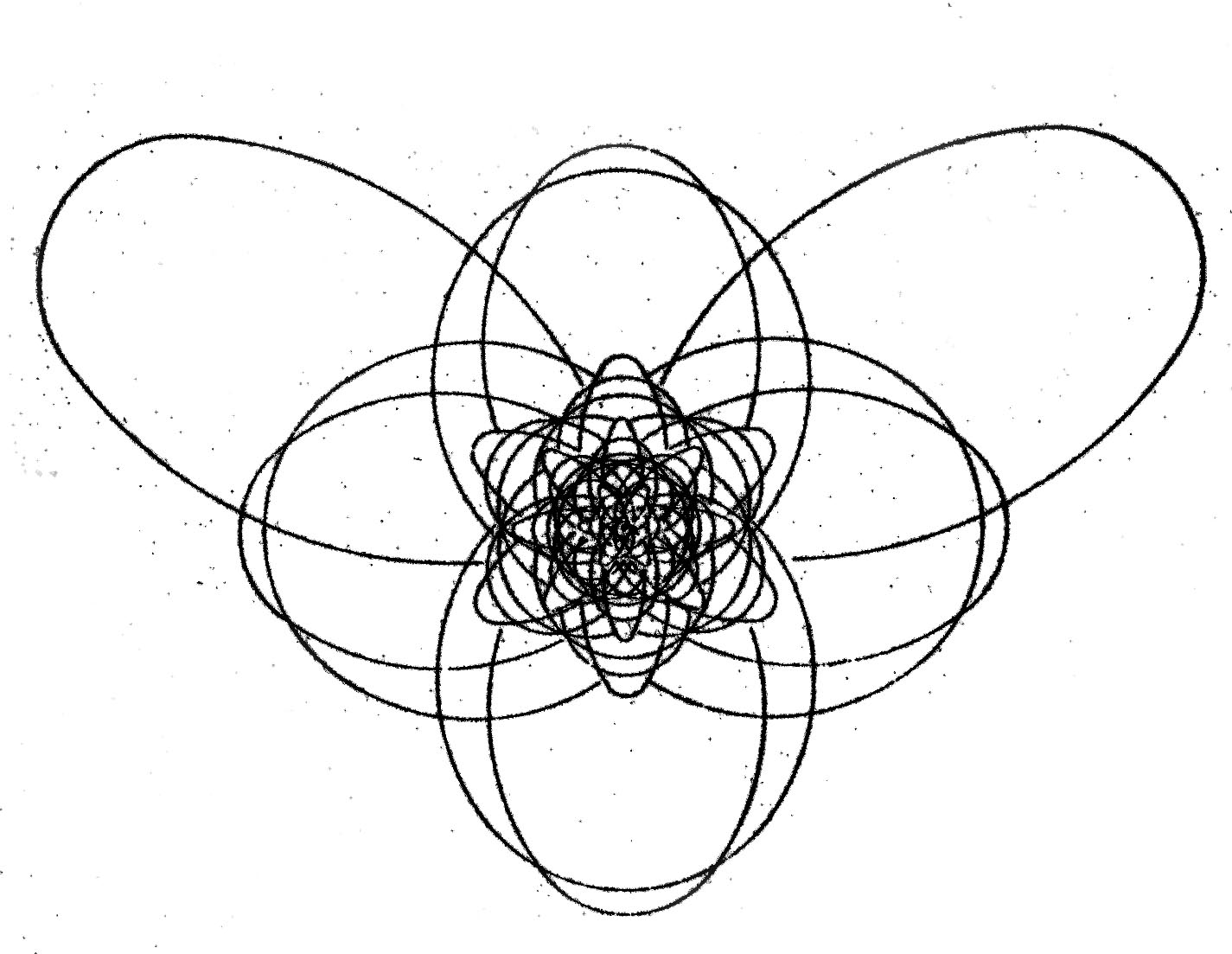 |
 |
| Neon | Natrium | Argon | Radium | Vatten |
Väteatomen är ungefär 10-8 cm, medan radiumatomen är ungefär fem gånger större.
Lägg märke till de jämna elektronskalen hos ädelgaserna neon och argon. Natrium har en elektron mer än neon och är då mycket kemiskt aktiv, då elektronen inte får plats i något symmetriskt ordnat mönster.
Syreatomen vill gärna bilda fyra symmetriska elektronbanor och förenar sig gärna med två väteatomer till en vattenmolekyl.
Ref: Forskning & Framsteg 4/78